这一发现可能会导致治疗炎症、冠状动脉疾病、癌症等的新药的开发
2019年,俄勒冈健康与科学大学(Oregon Health & Science University)的内科科学家、医学博士史蒂文·曼苏尔(Steven Mansoor)和他的研究团队取得了突破性的发现:他们确定了一种蛋白质的第一个完整结构,这种蛋白质与癌症、神经疼痛和脑部疾病等各种健康问题有关。

他们研究的蛋白质是P2X7受体,这是一种遍布全身的离子通道。P2X7是独一无二的:一旦它被激活,它会保持开放很长一段时间,让离子——带正电荷或负电荷的分子——随时进出细胞。这种长时间的离子交换会引发炎症,最终导致细胞死亡,这也许可以解释为什么它与炎症、动脉斑块、癌症扩散和神经系统问题等许多健康问题有关。

在今天发表在《科学进展》杂志上的一篇新论文中,Mansoor和Mansoor实验室的研究生Adam Oken利用先进的成像技术观察了P2X7受体与五种已知拮抗剂和一种他们发现的新拮抗剂结合后的结构。拮抗剂是与受体结合并阻止其激活的分子,有效地阻断受体功能。
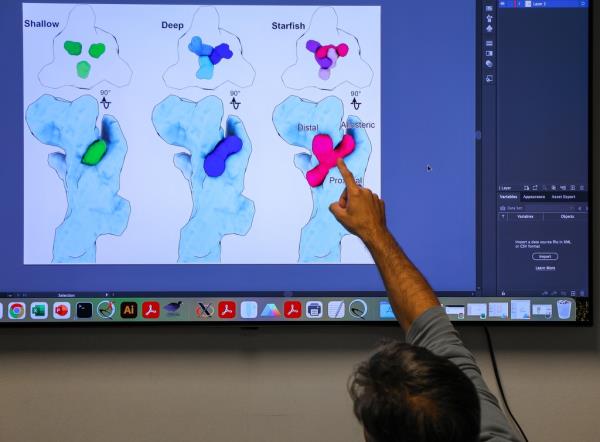
他们的发现揭示了这些拮抗剂如何与受体相互作用以阻断其功能,并表明至少有三种类型的阻滞剂:浅层,深层和海星。以新发现的甲基蓝配体为例,海星阻断剂表现出独特的特征,可以为开发更有效的治疗p2x7相关疾病铺平道路。
“有七种不同的亚型,从P2X1到P2X7,每一种都在细胞生理学的各个方面发挥重要作用,从中枢神经系统的过程到心血管系统和免疫系统的各个方面,”Mansoor说,他是OHSU医学院和奈特心血管研究所的医学(心血管医学)和化学、生理和生物化学助理教授。
“我们对了解七种P2X受体亚型在分子水平上的差异非常感兴趣。这很重要,因为如果你想设计一种阻断P2X7激活的药物,你就不想影响其他受体的功能。”
打开和关闭P2X7
8月发表在《自然通讯》(Nature Communications)上的曼苏尔实验室论文是对当前研究的补充。奥肯是这两篇论文的第一作者,他使用先进的成像技术观察了P2X7受体与一种名为BzATP的强激活剂结合的结构。他们发现,受体的三个特定部分在其对BzATP的强烈反应中起着关键作用,从而揭示了P2X受体是如何开启的。
现在,在《科学进展》的论文中,研究人员进一步研究了他们的发现,不仅弄清楚了如何开启受体,还弄清楚了如何关闭受体。Mansoor实验室的目标是开发能够精确定位和控制受体功能的分子。
奥肯说:“当P2X7被激活时,它发出信号,释放引发炎症的不安全分子。”“我们的目标是通过设计紧密结合的配体来关闭有害的P2X7信号传导,从而了解如何关闭P2X7活性。最终,这可能会导致有可能治疗心脏病、癌症和其他炎症性疾病的新疗法。”
2022年,Mansoor因其通过了解P2X受体在分子水平上的工作原理来开发更好的药物而获得了NIH主任的新创新者奖。这项最新的研究继续了他对药物开发的探索,以阻止这些参与炎症疾病的受体的激活。
Mansoor实验室的OHSU研究助理Ismayn Ditter,文学士,Nicolas Lisi,文学士,Ipsita Krishnamurthy,文学士,以及研究助理Michael Godsey博士,对这项研究做出了贡献。
Mansoor是OHSU优秀教师和创新奖的2020年获得者。
本研究由美国国立卫生研究院资助U24GM129547,在OHSU的PNCC进行,并通过EMSL (grid.436923.9)访问,EMSL是由生物和环境研究办公室赞助的美国能源部科学用户设施办公室。这项工作得到了美国国立卫生研究院(资助R00HL138129和DP2GM149551给S.E.M.)和美国心脏协会(资助24PRE1195450给A.C.O.)的支持。内容完全是作者的责任,并不一定代表NIH或AHA的官方观点。
为您推荐:
- 必看教程!“决战十三水如何提高拿好牌几率”(详细透视教程)-哔哩哔哩 2025-07-14
- 实测辅助“普通麻将机通用控牌器(专用辅牌神器免安装) 2025-07-14
- 玩家实测“安卓版QQ红包埋雷包控制尾数辅助神器”(详细透视教程)-哔哩哔哩 2025-07-14
- 实测结果“微信金花小程序辅助器(助赢神器通用版) 2025-07-14
- 实测辅助“吉祥填大坑必赢技巧(助赢神器通用版) 2025-07-14
- 实测辅助“雀神麻将有挂吗(助赢神器通用版) 2025-07-14


